Wundtherapie beim diabetischen Fußulcus
Die Konzepte der lokalen Wundbehandlung unterscheiden sich nicht zwischen Diabetikern und Nicht-Diabetikern.
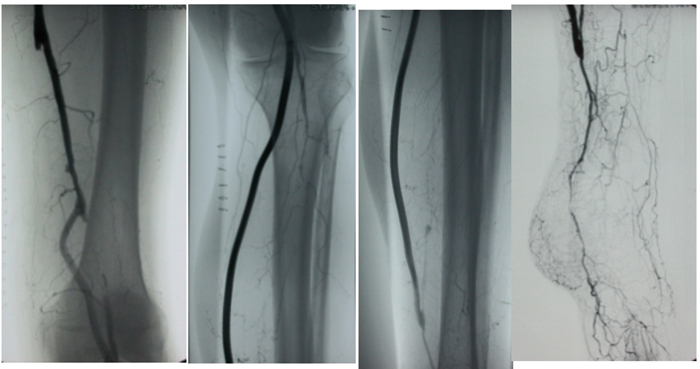
Grundzüge der Wundbehandlung wurden in den Leitlinien wie zum Beispiel der NVL zur Versorgung des diabetischen Fußsyndroms und der S3 Leitlinie der Deutschen Gesellschaft für Wundheilung und Wundtherapie zur Behandlung chronischer Wunden festgehalten und die allerdings spärliche Evidenz bewertet.




