Polyneuropathie, Schmerz u. Diabetes mellitus Typ II -Teil 4
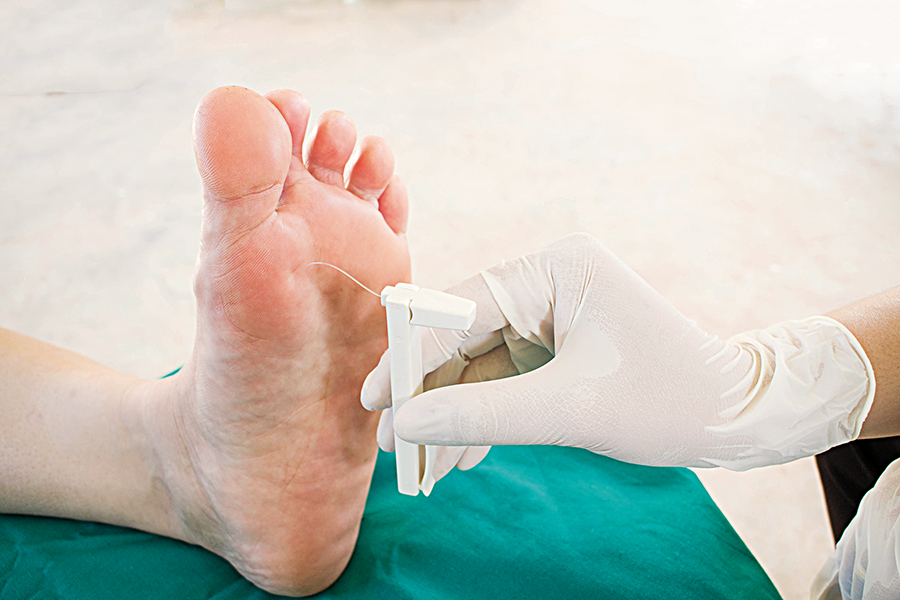
Eine charakteristische, sehr bedeutsame und einschneidende Komplikation des Diabetes mellitus ist die Polyneuropathie, die absolut bevorzugt im Bereich der unteren Extremitäten auf-tritt. Sie entsteht durch die zerstörerische „Verzuckerung“ der Strukturen der Leitungsbahnen. Auf dieser Grundlage zeichnet sich die Entwicklung der Polyneuropathie durch die Störung vieler Stoffwechselwege und die Störung der endoneuralen mikrovaskulären Versorgung aus (endoneural: Schicht lockeren Bindegewebes, umhüllt die einzelnen Nervenfasern und die zugehörigen Schwann-Zellen innerhalb eines peripheren Nervs).
Mit einem Abonnement erhalten Sie Zugriff auf alle Online-Inhalte. Mit einem Premium-Abonnement erhalten Sie zusätzlich viele Angebote rund um die Orthopädieschuhtechnik umsonst oder stark vergünstigt.
Nutzen Sie Ihr Abonnement auch digital und profitieren Sie von der großen Fachartikelvielfalt . Der Zugang ist bei Ihrem Abonnement bereits enthalten und für Sie kostenlos.




